PARTÍCULAS SUBATÓMICAS
- En todo átomo los electrones están representados por (e−). Los electrones de carga negativa rodean al núcleo, el cual a su vez de compone de protones (carga +) y neutrones (carga cero). El electrón es la partícula más pequeña y su movimiento genera corriente eléctrica. Los electrones que se encuentran en los niveles externos de un átomo son los que definen las atracciones con los demás átomos; estas partículas tienen un papel primordial en la química.
Partículas subatómicas
|
Símbolo
|
Carga
|
Masa relativa
|
Electrones
|
(e-)
|
-1
|
1/1,837 = 0
|
Protones
|
(p+)
|
+1
|
1
|
Neutrones
|
(n)
|
0
|
1
|
Todo átomo es neutro, ya que tiene el mismo número de protones y de electrones. Debido a que la masa del electrón es prácticamente cero, toda la masa de un átomo está contenida en su núcleo; por lo tanto, el número de masa es la suma de los protones y de los neutrones, y es igual al número de electrones cuando un átomo es neutro. Se representa por la letra (Z) y se escribe en la parte inferior de un elemento (X).
El número atómico es el número de protones que hay en el núcleo; todos los átomos de un elemento en particular tienen el mismo número de protones. El número de masa se representa por la letra (A), en la parte superior izquierda del símbolo de un elemento representado por (X).
En las partículas de un átomo, el número de protones determina qué elemento es. Así, un elemento que contiene 3 protones en el núcleo es un átomo de litio.
Formación de iones
Se puede producir una entrada de carga llamada ion en un átomo tomando un átomo neutro y adicionándole o sustrayéndole uno o más electrones, por ejemplo:
El sodio (Z = 11) tiene 11 protones (+) y 11 electrones (-), si pierde o cede un electrón tendrá 11 cargas positivas y 10 negativas. Esto forma un ion con carga neta positiva de 1(+):
(11+) + (10-) = 1+ El ion positivo es llamado catión
Isótopos
En el estudio de la desviación de los átomos se demostró que algunos núcleos del mismo número atómico pueden tener masas diferentes. Los isótopos son átomos de un mismo elemento, pero con distinto número de masa. Los isótopos de un mismo elemento son átomos cuyo núcleo es idéntico en cuanto al número de protones, pero con diferentenúmero de neutrones.
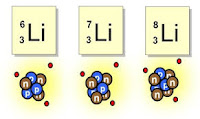
El litio que se encuentra en la naturaleza tiene tres isótopos, indicados de la siguiente manera:
OTRO EJEMPLO:
Todos los elementos químicos que se encuentran en la naturaleza son una mezcla de isótopos; la masa atómica que se encuentra representada en la tabla periódica es un promedio de todas las masas isotópicas naturales, razón por la cual la mayoría no son números enteros.
En nuestros días, las aplicaciones de los isótopos son muy numerosas, principalmente en la química, la biología, la medicina, la arqueología, las ciencias de la tierra, la alimentación, entre otras.
En la medicina se utilizan isótopos radiactivos en las imágenes (rayos x, tomografías) para estudiar la acción de los medicamentos, entender el funcionamiento del cerebro, detectar una anomalía cardíaca, descubrir las células cancerosas, etc.
En la arqueología el carbono 14 se utiliza para determinar la edad de los objetos de menos de 50.000 años. Existen otros métodos de datación que al hacer uso de diferentes isótopos permiten definir una edad para los acontecimientos, así como describir la historia de la tierra, de su clima y de los seres vivos que la han habitado hasta hoy.
En la industria, los isótopos son útiles para tomar radiografías industriales, por ejemplo, de la estructura de los aviones, la soldadura de oleoductos o para diagnosticar el estado de estructuras de concreto en puentes y edificios, también para verificar el contenido de sustancias químicas en el material en los procesos.
A lo largo de siglos de estudio e investigación, las teorías acerca del átomo han evolucionado hasta los tiempos modernos. Gracias a la ciencia y a la tecnología es posible tener un acercamiento a un modelo atómico cuya composición y estructura explica las incontables formas de materia que componen el universo. ´
ACTIVIDAD:
1. Los átomos de un mismo elemento químico tienen todos en su núcleo el mismo número de
.
2. Un átomo tiene 12 protones, 13 neutrones y 12 electrones. ¿Cuál es su número atómico?
- 12
- 13
- 24
- 25
3. Los isótopos oxígeno-16, oxígeno-17 y oxígeno-18, se diferencian en:
- El número de protones
- El número atómico
- El número de neutrones
- El número de electrones
4. Un átomo de volframio (W) tiene 74 protones y 108 neutrones. ¿Cuál es su representación adecuada?
5. Señala las afirmaciones correctas:
- El número másico de un átomo es la suma del número de protones, neutrones y electrones
- Todos los átomos de un mismo elemento químico tienen el mismo número de neutrones
- Los isótopos de un elemento químico tienen el mismo número atómico
- Los isótopos de un elemento químico tienen el mismo número másico
- Los isótopos de un elemento químico tienen distinto número de neutrones
6. Completa la siguiente tabla:
ELEMENTO
|
SIMBOLO
|
NÚMERO ATÓMICO
|
NÚMERO DE ELECTRONES (e-)
|
MASA ATÓMICA
|
NÚMERO DE NEUTRONES
|
NÚMERO DE PROTONES
| |
1
|
CLORO
| ||||||
2
|
K
| ||||||
3
|
14
| ||||||
4
|
8
| ||||||
5
| |||||||
6
|
F
| ||||||
7
|
15
|


No hay comentarios:
Publicar un comentario